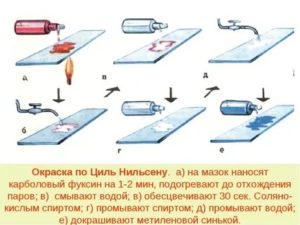
Окраска по цилю нильсену методика
Диагностика микобактериозов (туберкулеза) птиц

Микобактериозы – группа инфекционных заболеваний человека и животных, включая все виды птиц, вызываемая бактериями рода Mycobacterium.
Хронический дерматит у попугая (Amazon spp.), вызванный Mycobacterium kansasii. источник: «Avian and Exotic Animal Dermatology» Cheryl Greenacre
Большинство видов микобактерий
птиц вызывают хроническую (зачастую без проявления внешней симптоматики в течение длительного периода времени) полиорганную инфекцию с поражением печени, селезенки, легких, кишечника, суставной и костной ткани.
Также процесс может протекать локально, с поражением отдельных участков кожи и прилежащих тканей (чаще в области головы либо конечностей).
Некоторые виды возбудителя являются зооантропонозными, т.е.заразны для животных и человека. К ним относятся в том числе Mycobacterium tuberculosis, M.bovis и M.
avium, вызывающие у людей туберкулёз.
Передача возбудителя может происходить от птицы человеку и наоборот – в равной степени и люди, болеющие туберкулёзом, несут опасность заражения для домашних птиц, проживающих с ними.
Помимо трех вышеобозначенных видов, есть и другие микобактерии (M.fortuitum, M. scrofulaceum, M. intracellulare и др.), встречающиеся у птиц и потенциально опасные для людей.
Чаще они не вызывают системных поражений (тубёркулеза), однако могут провоцировать очаговые хронические дерматиты с образованием абсцессов; главным образом, к группе риска по подобным атипичным микобактериозам относятся дети младшего возраста, пожилые люди, ВИЧ-положительные, онко-больные, а также люди, проходящие химиотерапию или иммуносупрессивную терапию.
Проблема постановки диагноза на микобактериоз и лабораторной диагностики данного заболевания у птиц стоит весьма остро, и на то есть несколько причин:
1. неравномерное выделение возбудителя из организма больного животного – не каждая проба помета может нести в себе микобактерии или содержать достаточное их количество для диагностики. Отсюда вытекает две сопутствующие проблемы:1.
1 необходимость проведения серий анализов – окраска по Цилю-Нильсену, ПЦР, посевы на питательные среды– для постановки окончательного диагноза;
1.
2 зачастую требуется концентрация микобактерий в материале (методом флотации) перед проведением анализа, что в разы повышает эффективность обнаружения возбудителя при любом методе диагностики (окраске, ПЦР, посевах).
Микроскопия окрашенной по методу Циля-Нильсена мокроты человека, больного туберкулезом: справа на фото материал после концентрации (источник: статья «Методы окраски микроорганизмов» probakterii.ru)
2.
необходимость концентрации материала приводит к последующей сложности: соответствующее оснащение лабораторий для безопасной работы с концентрированным зооантропонозным возбудителем в материале для проведения анализов. Именно за счёт повышенного риска для сотрудников при работе с концентрированными пробами единицы лабораторий (как правило, это государственные лаборатории на базе НИИ) ведут данную деятельность.
Выдержка из статьи «Туберкулез – профессиональное заболевание у медицинских работников» В.В.Косарев, С.А.
Бабанов: «По степени риска заражения туберкулезом медицинские работники распределяются следующим образом: на первом месте — персонал бактериологических лабораторий (контакт с больными туберкулезом и живой патогенной культурой); затем — работники стационаров противотуберкулезных учреждений (контакт с больными с лекарственной устойчивостью микобактерий, что подтверждает внутрибольничный путь заражения); … распространенность латентной туберкулезной инфекции крайне высока среди медицинских работников (31,3 %), в особенности среди сотрудников противотуберкулезной службы (49,3 %)…»
[немаловажно: риск заражения владельца прямо пропорционален длительности его проживания с зараженной птицей, т.к.птица-бактериовыделитель способствует поддержанию высокой, нарастающей концентрации микобактерий в помещении, особенно при отсутствии регулярной уборки со специфическими дез.средствами, т.к.
микобактерии являются кислото-, спирто-, щёлоче-устойчивыми микроорганизмами, длительно сохраняющимися в окружающей среде]
Для диагностики микобактериозов у содержащихся в неволе птиц в России доступны следующие методы:
Окраска по методу Циля-Нильсена:
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, мазки-отпечатки органов при посмертной диагностике.
Принцип метода основан на обнаружении микобактерий при микроскопии материала – в готовом мазке они окрашены в красный цвет красителем фуксином Циля, т.к.являются кислотоустойчивыми, большинство же других микроорганизмов обесцвечивается (на этапе промывания мазка серной кислотой после фуксина) и затем окрашивается в синий (на этапе завершающей окраски метиленовой синью).
| Преимущества: | Недостатки: |
|
|
Окрашенные по методу Циля-Нильсена помёт жако – слева (более 40 микобактерий в поле зрения микроскопа), помёт сизого голубя – по центру (единичные микобактерии в поле зрения), помёт кореллы – справа (более 100 микобактерий в поле зрения). Фото автора.
При последующей сдаче помёта от данных пациентов на ПЦР-диагностику только от жако с первого же раза была получена положительная ПЦР и подтвержден возбудитель M.bovis.
Две другие птицы прореагировали ложно-отрицательно. Корелла прореагировала положительно при повторной ПЦР по помёту.Голубь прореагировал ложно-отрицательно при повторной ПЦР по помёту, но диагноз был подтвержден по ПЦР крови.
Пцр (полимеразная цепная реакция):
Материал: кровь, помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
| Преимущества: | Недостатки: |
|
|
Посевы на питательные среды:
Nathan Reading from Halesowen, UK – Mycobacterium kansasii, CC BY 2.0, Рост колоний M.kansasii на среде Левенштейна-Йенсена
Материал: помет, мокрота, мазки со слизистых оболочек и из очагов поражения кожи, синовиальная и перитонеальная жидкость, кусочки органов при посмертной диагностике.
Метод основан на культивировании (высевании) бактерий из материала на специальных питательных средах (наиболее часто используемой является среда Левенштейна-Йенсена), с целью обнаружения роста возбудителя и дальнейшего получения чистой культуры микобактерий для проведения последующей типизации.
| Преимущества: | Недостатки: |
|
|
Туберкулинизация (аллерго-диагностика):
Метод основан на выявлении местной аллергической реакции на введение птице внутрикожно туберкулина (готовится из очищенной убитой культуры микобактерий) – положительная реакция обуславливается специфическим иммунным ответом со стороны организма, т.е.свидетельствует об активном взаимодействии возбудителя микобактерий с организмом птицы.
| Преимущества: | Недостатки: |
|
|
Таким образом, выборочное использование только одного из представленных выше методов для постановки или опровержения окончательного диагноза на микобактериоз у птиц не является объективным.
Необходимо также учитывать, что даже единоразовое получение от обследуемого животного любого положительного результата при любом методе диагностики, является прямым показанием к рассмотрению птицы как подозрительной по микобактериозу, т.е.требующей системного разностороннего подхода к лабораторной диагностике и отбора серии проб в первую очередь для исключения опасности зоонатропонозной инфекции для владельца.
ветеринарный врач Мария Маркина.
заглавное фото: фрагмент картины Louis Edouard Dubufe
Источник: https://birds.vc/bolezni-ptitc/diagnostika-dlya-ptitc/diagnostika-analizi-mikobakterioz-tuberkulez-ptic.html
Бактериоскопическое исследование мокроты

Для проведения данных исследований необходимо следующее оснащение рабочего места:
- Предметные и покровные стекла.
- Шпатели и иглы.
- Смесь Никифорова.
- Газовая или спиртовая горелка.
- Пастеровская пипетка с резиновым баллончиком.
- Водяная баня с мостиком.
- Иммерсионное масло.
- Микроскоп.
- Фильтровальная бумага.
- Пинцеты Корне.
- Бумажки Синева.
- Основной фуксин.
- 96° этиловый спирт.
- Фенол.
- Глицерин.
- Концентрированная соляная кислота.
- Метиленовая синька.
- Дистиллированная вода.
- Генцианвиолет.
- Реактив Люголя.
- Едкий натр (NaOH).
- Бензин или ксилол.
Приготовление препаратов для бактериоскопического исследования
Для бактериоскопического исследования готовят обычно два препарата: один для обнаружения микобактерий туберкулеза и другой для обнаружения прочих микроорганизмов.
Для первого препарата отбирают те же частицы, которые были предназначены для микроскопии, для второго — гнойные частицы.
Взятый материал распределяют по предметному стеклу до получения достаточно тонкой ажурной сеточки (материал на первом стекле распределяют на 2/3 его поверхности, на втором — в центре).
Оба препарата фиксируют троекратным проведением над пламенем горелки. Первый препарат окрашивают по Цилю — Нильсену, второй — по Граму.
Окраска по Цилю-Нильсену
Для окраски препаратов по Цилю-Нильсену необходимы следующие краски и реактивы:
- Фуксин Циля: основного фуксина 1 г, глицерина 4 капли, этилового спирта 96° 10 мл, карболовой кислоты (5% раствор фенола) 5 мл, дистиллированной воды 90 мл. К фуксину, помещенному в фарфоровую ступку, прибавляют глицерин, хорошо растирают, постепенно приливают карболовую кислоту, спирт и воду. Фильтруют.
- 3% раствор солянокислого спирта: 3 мл концентрированной соляной кислоты удельного веса 1,19 и 97 мл 96° этилового спирта.
- 0,2 % водный раствор метиленовой синьки — 1 г метиленовой синьки растворяют в 500 мл дистиллирован- вой воды.
Техника окраски. На фиксированный препарат кладут полоску фильтровальной бумаги (уже и короче предметного стекла), на которую наливают в избытке фуксин Циля.
Затем препарат нагревают до появления паров (достаточно троекратно медленно провести его над пламенем горелки), дают ему остыть в течение 3-5 минут, сбрасывают с помощью пинцета бумажку, промывают препарат водой и наливают на него 3% раствор солянокислого спирта для обесцвечивания на 20 секунд. После этого препарат промывают водой и вновь повторяют обесцвечивание. Материал должен быть серовато-розового цвета. Затем на препарат на 20-30 секунд наливают 1: 500 водный раствор метиленовой синьки, краску сливают, препарат промывают водой и высушивают, установив в вертикальном положении на полоску фильтровальной бумаги.
Высушенный препарат рассматривают под микроскопом с иммерсией, с поднятым конденсором.
В препарате микобактерии туберкулеза (рис. 60) красного цвета, нежные, тонкие, слегка изогнутые, иногда зернистые. Иногда обнаруживают микобактерип туберкулеза в виде так называемых осколков (в составе тетрады Эрлиха).Рис. 60. Микобактерии туберкулеза в мокроте. 1 — окраска по Цилю-Нильсену, 2 — в люминесцентном микроскопе.
Все остальные элементы, в том числе и другие микроорганизмы, окрашены в синий цвет. С целью обнаружения мпкобактерий туберкулеза препарат тщательно исследуют, продвигая от одного продольного края к другому и поперек мазка.
Во всех сомнительных случаях рекомендуют обработать препараты жавелевой водой
Результат исследования оформляют, используя следующую формулировку: «микобактерип туберкулеза не обнаружены» или «микобактерип туберкулеза обнаружены», и отмечают приблизительное их количество, например, «единичные в препарате», «единичные в поле зрения» и т. д.
В настоящее время находит все большее распространение люминесцентный способ обнаружения микобактерий туберкулеза в мокроте. Микобактерип туберкулеза имеют золотисто-желтое свечение на черном фоне препарата (рис. 60, 2).
В тех случаях, когда количество микобактерий туберкулеза в мокроте незначительно, для их обнаружения применяют метод обогащения (флотация), который состоит в следующем. В бутылку с нешироким горлышком (емкостью 250 мл) помещают 12-20 мл мокроты, добавляют равный объем 0,5% раствора КОН и встряхивают 5-10 минут.
Затем приливают около 10 мл дистиллированной воды и 0,5-1 мл бензина или ксилола, взбалтывают 10-15 минут и доливают дистиллированную воду гак, чтобы горлышко бутылки было заполнено. Смесь оставляют на 1-2 часа до образования на поверхности жидкости сливкообразного слоя.
На два предметных стекла, заранее расположенных на мостике над водяной баней, нагретой до 60-65°, каплями, с помощью пастеровской пипетки, 5-6 раз наносят сливкообразный слой, каждый раз после подсыхания предыдущей капли.
Мазки окрашивают фуксином Циля на водяной бане (без дополнительной фиксации) в течение 10 минут, промывают водой, 3-4 минуты обесцвечивают 3% раствором солянокислого спирта, вновь обмывают водой, докрашивают 0,2% водным раствором метиленовой синьки, высушивают и исследуют под микроскопом.
Окраска по Граму
Для окраски препаратов по Граму требуются следующие краски и реактивы:
- Разведенный фуксин Циля (фуксин Пфейффера): 1 часть фуксина Циля + 9 частей дистиллированной воды.
- Реактив Люголя.
- 1 % спиртовой раствор генцианвиолета — 1 г генцианвиолета растворяют в 100 мл 96° этилового спирта. Этот раствор краски можно заменить бумажкой, приготовленной по методу Синева (белую фильтровальную бумажку пропитывают 1% спиртовым раствором генцианвиолета, затем высушивают и разрезают на мелкие квадратики соответственно размеру мазка).
Техника окраски. На фиксированный препарат накладывают бумажку Синева и смачивают ее водой (при отсутствии бумажки Синева ее заменяют белой фильтровальной бумажкой, на которую наносят несколько капель 1% спиртового раствора генцианвнолета). Через 1-2 минуты бумажку сбрасывают и на препарат наливают 1-2 капли реактива Люголя.
Через 1-2 минуты препарат обесцвечивают 1-2 каплями 96° этилового спирта до появления бледно-серой окраски материала, смывают водой, на 10-15 секунд наносят сруксин Пфейффера, после чего вновь смывают водой и высушивают. В препаратах могут быть обнаружены (рис.
61) стафилококки, стрептококки, диплококки, палочки Пфейффера, спирохеты Плаута-Венсана, актиномицеты и другие микроорганизмы.
Рис. 61. Различные микроорганизмы в мокроте: диплококки (1), палочки Пфейффера (2), стрептококки (3), стафилококки (4), диплобациллы Фридлендера (5), симбиоз Венсана (6), мицелий актиномицет (7).
Обеззараживание мокроты, посуды и предметов, бывших в соприкосновении с ней
После проведенного исследования мокроту сжигают или обеззараживают. Последнее достигается следующими способами: а) автоклавированием в течение одного часа при 1,5 атм.
; б) кипячением в течение одного часа в 1-2% растворе соды; в) обработкой 5% раствором лизола, карболовой кислоты или смесью, состоящей из равных объемов 5% раствора хлорамина и 5% раствора сернокислого аммония, в течение 12-24 часов.
После обеззараживания посуду тщательно моют водой и высушивают.
https://www.youtube.com/watch?v=SHpQhyEMBnY\u0026list=PLr3aXK2YdkeOaiMRGUKVxPKf_YX85u7T7
Металлические предметы (шпатели, иглы) обеззараживают прокаливанием над огнем. Во избежание переноса микроорганизмов из одной порции мокроты в другую шпатель и иглу немедленно прокаливают после отбора соответствующих частиц.
Покровные стекла опускают в небольшую плоскую чашечку с 40% раствором серной кислоты на 12-24 часа. Затем кислоту сливают, а стекла неоднократно промывают водопроводной и дистиллированной водой. Вымытые стекла высушивают и используют для последующих исследований.
Источник: http://ginekolog.my1.ru/publ/klinicheskie_issledovanija/mokrota/bakterioskopicheskoe_issledovanie_mokroty/40-1-0-771
Окраска кислотоустойчивых микроорганизмов

В природе существуетгруппа микроорганизмов, устойчивых кдействию кислот, щелочей и спиртов. Ониотносятся к роду Mycobacterium(возбудители туберкулеза, паратуберкулезакрупного рогатого скота, проказычеловека).
Химическая структура цитоплазмыи клеточной оболочки микроорганизмовданной группы отличается содержаниемзначительного количества жировосковыхвеществ, в частности стеариновых кислот(в том числе фтионовой кислоты до 40%),поэтому проникновение красителя вклетку затруднено.
Для их окраскииспользуют протравливание (нагреваниемазка с красителем над пламенем).Окрасившись, они прочно удерживаюткраску и не обесцвечиваются кратковременнымдействием кислоты.
Окраска по Циль-Нильсену
1. Фиксированныйна пламени мазок покрывают полоскойфильтровальной бумаги, наливают на неекарболовый раствор фуксина и подогревают;при появлении паров прекращают нагреваниеи оставляют краску на препарате еще нанесколько минут (2—3 минуты). Дав препаратуостыть, удаляют пинцетом бумажку иобмывают мазок водой.
2. Обесцвечиваютпрепарат 5—10% водным раствором сернойкислоты в течение 3—5 секунд (дожелтоватого оттенка мазка). Вместосерной кислоты можно применить 5% растворазотной или 3% раствор соляной кислоты.
Мазок тщательно промывают водой.
Споласкивают 96°спиртом.
5. Снова промываютводой.
6. Докрашивают втечение 3—5 минут леффлеровскойметиленовой синькой или водным раствором1: 1000 малахитовой зелени или метиловойзелени.
7. Краску смываютводой и препарат высушивают.
Микроскопическаякартина: туберкулезные палочки — рубиновокрасные, остальные, за исключениемвозбудителя паратуберкулеза, кислото- и спиртоустойчивых сапрофитов, — синие.
Для обесцвечивания мазков при окраскепо Циль-Нильсену вместо растворов кислоти спирта особо рекомендуется применениесолянокислого алкоголя (соляной кислоты3 мл+96° спирта 97 мл) до слабо заметногорозоватого оттенка препарата. Послеэтого мазок ополаскивают водой идокрашивают метиленовой синькой и т.д. по основной прописи.Указанным методомдостигается одновременное испытаниебацилл на кислото — и спиртоустойчивость.Среди видов кислотоустойчивых сапрофитоввстречаются спиртоподатливыеразновидности, палочки же туберкулезаи паратуберкулеза всегда кислото — испиртоустойчивы.
Занятие 4. Окраска спорообразующих и капсулообразующих бактерий. Определение подвижности микроорганизмов
Цель занятия.Усвоить методы окраски спорообразующих,капсулообразующих бактерий, а такжеопределение подвижности бактерий.
Материалы иоборудование. Взвеси бактерий свакцинным штаммом сибирской язвы,клостридиями, готовые препараты скапсулообразующими бактериями, подвижныебульонные культуры эшерихий 18 часовогороста, предметные и покровные стекла,плакаты, 2% раствор сафранина, водныйраствор малахитовой зелени, карболовыйфуксин Циля.
Методическиеуказания. Каждый студент готовитмазки из взвесей микроорганизмов иокрашивает их по методу Трухильо, Ольта,микроскопирует и зарисовывает; готовитпрепарат для изучения подвижностимикроорганизмов методом «раздавленная»и «висячая» капля.
Окраска спор. Принеблагоприятных условиях для микробов(отсутствие питательной среды, высушивание,неблагоприятная температура и др.) вцитоплазме некоторых микроорганизмовобразуются споры. Формируются они внутривегетативной клетки, являясь эндоспорами.
https://www.youtube.com/watch?v=mpJmjd5YYMI\u0026list=PLr3aXK2YdkeOaiMRGUKVxPKf_YX85u7T7
Палочковидные грамположительныемикроорганизмы, образующие округлыеспоры, диаметр которых не превышаетширину микробной клетки, относятся кродуBacillusи называютсябациллами. Микроорганизмы родаClostridiumимеют споры диаметр которых превышаетширину микробной клетки и называютсяклостридиями.
По форме они бываютовальные и круглые (рис. 5).
Споры устойчивык воздействию высоких температур,химических веществ, к высыханию, длительносохраняются в почве, что объясняетсяих особым строением и химическимсоставом, в особенности ее оболочки.Поэтому споры стойки к действиюкрасителей.
Все методы окраскиспор основаны на обеспечении проникновениякрасителя через трудноокрашиваемуюоболочку споры. Поэтому применяютпротраву. После охлаждения оболочкавновь становится плотной и не пропускаетдополнительный краситель.
Техника окраскиспор методом Трухильо. На фиксированныймазок накладывают небольшой кусочекфильтровальной бумаги и на нее наносятводный раствор малахитовой зелени.
Рис.5. Споры микроорганизмов различных типов
Подогреваютпрепарат на пламени горелки до появленияпаров и выдерживают в течение 3 минут,промывают водой и докрашивают 0,25%-нымводным раствором основного фуксина 1минуту. Промывают водой и высушивают.Микрокартина: споры зеленые, а вегетативныеклетки красные.
Окраска капсул.Тело микробной клетки покрыто рыхлымслизистым слоем. У некоторых видовмикроорганизмов этот слой развиваетсяочень сильно и тогда он называетсякапсулой. Капсула — муциноподобноевещество, высокомолекулярный полисахарид,является производным наружного слояоболочки.
Наличие капсулы являетсяважным диагностическим признаком приидентификации и дифференциациивозбудителей некоторых инфекций(сибирской язвы, пневмококковой пневмониии др.) (рис. 6). Патогенные микроорганизмыобразуют капсулу в инфицированноморганизме. Она является факторомвирулентности и защищает бактериальнуюклетку от фагоцитоза и бактерицидногодействия сыворотки крови.
Капсульноевещество плохо окрашивается. Поэтомупри приготовлении препарата дляобнаружения капсулы выполняют следующиеправила:
а) мазок готовятиз свежего материала, так как капсулабыстро лизируется;
б) фиксируют мазокхимическим способом, для окраскиприменяют метохромотические краски,то есть при использовании, которыхцитоплазма окрашивается в один цвет, акапсула — в другой;
в) промывать мазокводой следует слабо и кратковременно.
Техника окраскакапсул по методу Ольта. Свежий горячий2%-ный раствор сафранина наносят нафиксированный мазок, окрашивают 5-7минут. Быстро промывают водой и высушивают.Тело клетки окрашивается в краснокирпичныйцвет, капсула в — желто-оранжевый.Определение подвижности бактерий.
Подвижностибактерий важный видовой признак ипроизводиться при диагностическихисследованиях: результат учитывают приидентификации микроорганизмов. Уподвижных видов способность самостоятельногопоступательного (и вращательного)движения обусловлена наличием жгутиков— специальных тонких нитевидныхобразований.Рис.6.Капсулау бактерийа ‑ бацилласибирской язвы; б — диплококк
Жгутики бываютразличной длины.
Их диаметр настолькомал, что они невидимы в световом микроскопе(менее 0,2 мкм). У разных групп бактерийколичество и расположение жгутиковнеодинаково. Жгутики плохо воспринимаюткрасители.
Методы сложной окраскиискажают подлинный вид жгутиков, поэтомув лабораториях окраску жгутиков неосуществляют, а исследуют бактерии вживом состоянии.
В зависимости отрасположения и количества жгутиковмикробы подразделяют (рис. 7):
а) монотрихи -микроорганизмы, имеющие на одном изполюсов один жгутик, движения активные,поступательные (псевдомонас);
Рис. 7. Типы расположения жгутиков у бактерий
б) лофотрихи— микробы, имеющие на одном из полюсовпучок жгутиков (листерии);
в) амфитрихи— микробы, имеющие жгутики на обоихполюсах микробной клетки;
г) перитрихи -микробы, у которых жгутики расположеныпо всей поверхности клетки(E.coli).
Есть видымикроорганизмов, обладающие подвижностью,но жгутиков не имеют (спирохеты,лептоспиры). Их движение обусловленоимпульсивными сокращениями двигательногофибриллярного аппарата микробнойклетки.
Для определенияподвижности у бактерий необходимоиспользовать культуру не старше суточноговозраста, так как старые культурыутрачивают способность передвигаться.
Определениеподвижности бактерий методом «висячаякапля». Каплю молодой (18-20 часовой)бульонной культуры бактерийбактериологической петлей наносят напокровное стекло.
Специальным предметнымстеклом с углублением (луночкой) накрываюткаплю культуры так, чтобы покровноестекло с каплей находилось в центрелуночки и прилипло к предметному стеклу(края луночки предварительно слегкасмазывают вазелином). Препаратперевертывают стеклом вверх, и капля«повисает» над луночкой (рис. 8).
Препаратмикроскопируют при затемненном полезрения, сначала при малом, затем присреднем или большом увеличении. Насветлом фоне микробы темно-серые.Методом Шукевича. Для этого каплюмикробной взвеси наносят в конденсатскошенной плотной питательной среды впробирке.
Подвижные микроорганизмы,передвигаясь из конденсата, растут наповерхности среды; неподвижные видыразмножаются только в конденсате среды(«не заходя» на поверхность агара).Рис. 8. Исследование микробов на подвижностьа ‑ стекло с луночкой; б ‑ «висячая капля»
Метод «раздавленнаякапля». Каплю бактериальной взвесинаносят на обычное предметное стекло,осторожно накрывают покровным стекломи слегка придавливают пальцем. Микроскопиюпроводят, так же как и в методе «висячаякапля».
Метод посевауколом в полужидкий агар. Для этогобактериологическойпетлей производятпосев исследуемой культуры уколом додна пробирки с полужидкой питательнойсредой. Подвижная культура растет повсей питательной среде, образуяравномерное помутнение, а неподвижная- только по уколу в виде стержня, сохраняяпрозрачность незасеянного участкасреды.
ЗАНЯТИЕ5. Лабораторная посуда и её подготовка.Питательные среды. Методы приготовленияи стерилизации питательных сред. Методыстерилизации лабораторной посуды.
Цель занятия.Подготовить посуду. Приготовитьпитательные среды. Определить рН сред.Ознакомиться с методами стерилизациипитательных сред и лабораторной посуды.
Оборудование иматериалы.Штативы, пробирки, микробиологические петли, пипетки,чашки Петри, бумага. Автоклав,сушильный шкаф. Набор сред и химическихреактивов. рН -метр.
Источник: https://studfile.net/preview/1152683/page:5/
Методы окраски бактерий по Граму, Цилю-Нильсену, Нейссеру
Мы живем в мире бактерий. Они вокруг нас и внутри нашего организма. Не удивительно, что мы хотим знать о них как можно больше.
Но как рассмотреть и тем более изучить что-то настолько маленькое? Микроскоп, казалось бы, должен решить эту проблему. Но не все так просто – в своем естественном состоянии микроорганизмы прозрачны как стекло.
«Проявить» картинку помогают различные методы окраски бактерий, помогающие исследовать внешнее и внутреннее строение микробов.
Как все начиналось
В конце девятнадцатого века датский биолог Кристиан Грам предложил решение этой проблемы. Если что-то невидимо, его нужно покрасить и посмотреть, что получится. Метод окраски бактерий, предложенный Грамом, был настолько убедителен, что и по сей день микроорганизмы разделяют на грамположительные (удерживающие окраску) и грамотрицательные (обесцвечивающиеся после обработки спиртом).
Как оказалось, клетки покрыты оболочкой, похожей на переплетенные между собой нити.
И хотя в просветы между нитями свободно проходят питательные вещества, необходимые клетке, оболочка надежно защищает «внутренний мир» от внешних агрессивных факторов.
У разных видов бактерий наружная стенка клетки имеет различную толщину, плотность и химический состав. Именно на этом свойстве клеточных оболочек базируется метод окраски по Граму.
Отталкиваясь от работ Кристиана Грама, биологи разработали новые методы, позволяющие не только определить форму и размер клеток, но и рассмотреть некоторые подробности их строения. Иногда микроорганизмы, совершенно идентичные по внешнему виду, по-разному реагируют на красители. Полученная информация дает возможность быстро и точно определить вид бактерий.
Старый – не значит плохой
Пожалуй, самый практичный и широко применяемый способ окрашивания микроорганизмов – метод Грама. Мазок, зафиксированный огнем, покрывают метиловым фиолетовым красителем, фиксируют йодом, просушивают и промывают спиртом. На этом этапе, в зависимости от свойств клеточной мембраны, бактерии становятся:
- ярко-синими (грамположительные);
- бесцветными (грамотрицательные).
Толщина оболочки клеток, оставшихся бесцветными, не позволяет краске проникнуть внутрь, и она легко смывается с поверхности бактерий. Последним шагом окрашивания по Граму является использование красного красителя, он остается на поверхности клеточной мембраны и придает ей розовый или красный оттенок.
Грамположительные бактерии, как правило, опасны для человека. К этой категории относятся стрептококки, стафилококки, бациллы, клостридии и т. д. Грамотрицательные не настолько опасны.
Они тоже могут вызывать болезни и воспаления, но только при определенных условиях.
Таким образом, просто приготовив окрашенный препарат, можно получить представление о степени опасности исследуемых микроорганизмов.
Витальные методы окраски
По состоянию исследуемых организмов в микробиологии существуют:
- витальный способ, т. е. работа с живыми бактериями (опасен, требует строгого соблюдения техники безопасности);
- поствитальный метод – работа с фиксированными (убитыми) клетками;
- негативный, может быть витальным и поствитальным, удобен для работы с капсулами.
Витальный метод, безусловно, самый опасный, так как исследователям приходится иметь дело с живыми клетками, иногда представляющими смертельную опасность. Однако именно такой способ дает возможность изучать не только строение клетки, но и весь ее жизненный цикл и взаимодействие с окружением.
Для многих микробиологических исследований важно сохранить бактерии живыми.
Это значит, что нужно использовать специальные нетоксичные или низкотоксичные красители, к тому же легко проникающие в структуру клетки через наружную оболочку.
Это так называемые витальные красители, они могут быть предназначены для видимого света или флуоресцентными. По химическому составу красители разделяются на:
- основные (акридиновый оранжевый, метиленовый синий);
- кислотные или кислые (индигокармин, кислый фуксин);
- нейтральные (родамин В).
Работа с фиксированными препаратами
По сложности работы методы окраски фиксированных (неживых) клеток разделяются на:
- Простые методы. В этом случае используют только одну краску, как правило, красную (фуксин) или синюю (метиленовый синий). Разница между этими красителями состоит в скорости воздействия. Фуксин дает результат уже через 1-2 мин., тогда как результат работы синей краски нужно ждать 3-5 мин. Использовать раствор фуксина в карболовой кислоте (т. н. фуксин Циля) удобно еще и потому, что приготовленный препарат в течение нескольких месяцев не теряет окрашивающих свойств. Метиленовый синий краситель тоже может быть подготовлен заранее в крепком спиртовом растворе.
- Сложные (дифференциальные) методы. Здесь потребуется несколько красителей (минимум два), имеющих различный цвет. Это позволит не просто увидеть бактерии, но и подробнее изучить их внутреннее строение, так как различные участки клетки могут по-разному воспринимать красители. К сложным относят методы Грама, Циля – Нильсена (для кислотоустойчивых бактерий), Бениньетти (окраска бактериальных жгутиков), Гинса (выявление капсул), дифференцирующий метод Романовского – Гимзы (окраска спор) и некоторые другие.
Особенно важны сложные методы для диагностики инфекционных заболеваний, например, способ окраски Нейссера помогает отличить дифтерийную палочку от ложнодифтерийных.
Дифференцирующий способ Романовского – Гимзы основан на применении специального готового порошка, на основе которого лаборатории готовят раствор красителя нужной концентрации. Преимущество этого способа в том, что цитоплазма и ядро клетки получают различную окраску, что облегчает идентификацию и изучение микроорганизмов.
Метод Нейссера используют в медицине для обнаружения зерен волютина (гранул с запасом пищи для многих прокариотических клеток) у возбудителей дифтерии. В результате окрашивания бактерия приобретает желтый цвет, а гранулы волютина – синий.
Белым по черному
Еще одна разновидность окраски бактерий основана на свойствах негатива, т. е. на темном фоне препарата четко видны бесцветные бактерии, иными словами, окрашивается среда, а не сам организм.
Иногда бактерии, попадая в определенные условия, образуют капсулы. Это слизистые образования, покрывающие клетку, чем-то похожие на гель. Капсулы прозрачны, их химический состав может сильно отличаться у разных видов бактерий, т.е. просто покрасить и оценить результат по получившемуся цвету не выйдет.
Кроме того, капсулы мягкие и непрочные, при окраске они могут потерять форму. Красящие вещества плохо взаимодействуют с желеобразной структурой капсул и легко вымываются при обработке. Чтобы обнаружить, но не повредить капсулы, пригодится негативный способ окрашивания.
Одним из способов выявления капсул является метод окрашивания по Гинсу. Каплю черной туши наносят на край предметного стекла, вносят в нее исследуемый материал, перемешивают и распределяют по всей поверхности.
Мазок сушат на воздухе, фиксируют и окрашивают фуксином Циля. Через 2-3 минуты промывают водой и высушивают.В результате под микроскопом на общем темном фоне отчетливо просматриваются розовые клетки, окруженные прозрачными капсулами.
Окраска спорообразующих бактерий
Если говорить о клеточных оболочках, то нельзя не вспомнить о спорообразующих бактериях. Споры образуются при неблагоприятных для клетки условиях и могут существовать в агрессивной среде довольно длительное время.
То, что хорошо для сохранения клетки, плохо для ее изучения. Споры очень плотные и почти не пропускают жидкости, кроме того, они кислотоустойчивы. Следовательно, простое окрашивание или метод Грама оставят споры бесцветными.
Перед началом окрашивания приходится химически обрабатывать поверхность спор, чтобы она немного изменила свою структуру и позволила красящим веществам проникнуть внутрь. При этом окрашивается и вся цитоплазма клетки. Чтобы обесцветить цитоплазму, препарат промывают и высушивают. Краска в спорах, благодаря их более плотной структуре задерживается лучше, чем в цитоплазме.
Способы окраски спор могут быть разными, например, Ожешко или Циля – Нильсена, но все они сводятся к одной схеме:
- разрыхление поверхности спор химическими веществами (кислоты, аммиак, едкий натр);
- окрашивание клетки со спорой (обычно при нагревании);
- обесцвечивание цитоплазмы.
В результате получаем отлично видимую ярко окрашенную спору и бледную, почти прозрачную цитоплазму.
Как рассмотреть бактериальные жгутики
Еще одна непростая задача – окраска бактерий со жгутиками. Это спирально закрученные очень тонкие нити, которые микроорганизмы используют для перемещения. Жгутики необычайно тонкие, при окрашивании они легко отрываются от клетки. Поэтому перед началом окрашивания жгутики протравливают, искусственно увеличивая в объеме.
При подготовке микроорганизмов к исследованию бактериальную культуру несколько раз пересеивают на свежую питательную среду в течение нескольких дней. Затем бактерии со жгутиками переносят в пробирку со стерильной водой (t 37⁰С). Делают это предельно осторожно, не перемешивая жидкость, чтобы не повредить жгутики.
Содержимое пробирки оставляют примерно на час, чтобы бактерии равномерно распределились по всему объему. Перед началом исследования проверяют подвижность клеток в висячей капле. Если движения нет, пробирку оставляют еще на некоторое время.
При нанесении раствора на предметное стекло клетки могут легко потерять жгутики. Поэтому поверхность стекла должна быть идеально чистой и обезжиренной. Перед нанесением капель раствора предметное стекло проводят над горячей частью пламени горелки, чтобы попавшие на поверхность капли расплылись и быстро высохли.После высыхания мазок протравливают, через 15 минут химикат смывают. Следующий этап – окраску фуксином – проводят, погружая стекло в раствор красителя, чтобы не повредить жгутики при нанесении краски.
Выдержав нужное время, мазок промывают водой и высушивают. Теперь можно переходить к исследованию получившегося результата.
Техника окрашивания
Для получения окрашенного препарата нельзя просто взять кисточку, краски и отловить бактерию. Существует определенная схема работы с микроорганизмами:
- Приготовление мазка. На предметное стекло (стерильное) наносят каплю воды, в которую затем бактериологической петлей вносят и распределяют по поверхности лабораторный материал.
- Высушивание. Лишняя жидкость высушивается либо естественным путем при комнатной температуре, либо мазок немного прогревается высоко над пламенем горелки.
- Фиксация. Мало просто убрать воду, нужно закрепить бактерии на предметном стекле. Для этого можно использовать огонь (несколько проходов над самой горячей частью пламени) или жидкость (спирт, ацетон). После такой обработки микроорганизмы быстрее впитывают краску.
- Непосредственно окрашивание. Краска должна полностью покрывать всю поверхность мазка. Выдержав нужное время (для каждого красителя свое), краску убирают и промывают препарат водой.
После высыхания (обычно естественным путем) полученный результат можно использовать по назначению.
Окрашивание микроорганизмов – это целая система методов, приемов, схем, направленных на обнаружение и распознавание клеток при помощи микроскопа. Ни одно медицинское исследование или научная работа в микробиологии не обходятся без предварительной подготовки и окраски изучаемого материала.
Образование высшее филологическое. В копирайтинге с 2012 г., также занимаюсь редактированием/размещением статей. Увлечения — психология и кулинария.
Источник: https://probakterii.ru/prokaryotes/raznoe/metody-okraski-bakterij.html